| 导 读
2019年7月27日, 首都师范大学周晶课题组在Biomaterials (IF: 10.273) 杂志上,发表题为“DNA-templatedporous nanoplatform towards programmed “double-hit” cancer therapy via hyperthermia and immunogenicity activation”的研究论文,利用全新的DNA模板水热法构建了一种具有优异的亲水性和介孔结构新型CO9S8纳米平台。该平台同时装载HSP90抑制剂表没食子酸儿茶素和免疫激活作用奥沙利铂,通过磁共振激活光热疗法和免疫原性实现程序化“double-hit”协同肿瘤治疗。
| 内 容
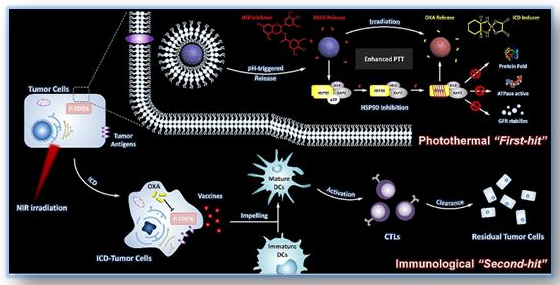
Scheme1. PCS-EGCG-OXA的增强光热疗法及激活免疫作用机理。
pH触发释放的EGCG可以通过激活HSP90与AHR和XAP2的相互作用,从而提高光热治疗效率,实现是肿瘤消融术的“first-hit”。热触发释放的OXA作为一种ICD诱导剂,可以将死亡的肿瘤细胞转化为疫苗,由DCs吞噬并呈现,导致CTLs的深度激活和肿瘤特异性免疫反应,产生一种长期的免疫“second-hit”来清除“first-hit”残留肿瘤细胞。
光热疗法(PTT)通过激活相关的细胞生物学过程并诱导肿瘤细胞不可逆的结构损伤,从而产生长期的免疫抗肿瘤作用,因而被公认为是一种有效的肿瘤抑制方法。然而,短暂的高热使肿瘤细胞产生了耐热性,这种耐热性通常与某些特定的热相关功能性生物分子的合成有关,如热休克蛋白(HSP)。一些HSP抑制剂,如天然植物的提取物表没食子酸儿茶素(EGCG),因其高生物相容性,具有很好的实用价值。据以往的研究,抑制HSP功能可以破坏细胞内稳态,干扰蛋白质相互作用的完整性,从而降低细胞的耐热性,可以起到提高光热治疗效率的作用。
光热疗法示意图(本图来源于互联网)
然而,尽管如此,仍有少量肿瘤细胞从光热诱导的热损伤中存活下来。因此,需要优化光热疗法以清除剩余的肿瘤细胞。最近的报告发现,免疫原性细胞死亡(ICD)诱导剂可以杀死肿瘤细胞,将其转化为疫苗,并释放免疫刺激性抗体。值得注意的是,这些疫苗可以被齿状细胞(DCs)吞没并呈现,导致细胞毒性T淋巴细胞(CTLs)深度活化,刺激肿瘤特异性免疫反应,从而提供长期的抗肿瘤作用。
因此,免疫治疗可以作为清除肿瘤残留细胞的方法。利用HSP抑制剂增强的PTT,作为“first-hit”抑制肿瘤细胞增殖;ICD诱导的免疫治疗作为“second-hit”,消除其残留细胞的威胁,高效地抑制肿瘤细胞,提高治疗效果。
癌症的免疫疗法(本图来源于互联网)
报告显示,纳米平台在癌症治疗中用于药物输送的可行性。为实现这种方法,需要设计出一个具有优异的光热转换、HSP抑制剂和ICD诱导剂传递特性的合理的纳米平台。药物是在pH和高热的触发下从纳米平台逐步释放出来的,,兼顾了高效的肿瘤消融术和长期的抗肿瘤免疫作用。因此,研制的多孔纳米平台,为下一代纳米药物在临床肿瘤治疗中的发展提供了新的策略。
硫化物半导体纳米材料(SSN)具有较强的近红外吸收能力和良好的生物相容性,自发现以来,有望成为一种有前途的光热转化剂。因此,具有多孔结构的SSN可以满足“double-hit”协同治疗方法的高要求。周晶课题组利用“一步法”制备多孔SSN,解决了多步合成方法可能受到多种条件的限制。许多研究表明,脱氧核糖核酸(DNA)和核苷酸等生物分子可以作为纳米材料合成的模板。虽然生物模板法不仅能简单地实现形态控制,而且比传统表面活性剂模板法具有更好的生物相容性,但这种方法在多孔SSN的开发方面做的努力有限。
周晶课题组首次开发了一种简单的DNA模板水热法制备均匀多孔硫化钴纳米材料(PCS),用于光热疗法和药物输送。进行了详细的毒性检查,以确认生物应用过程控制系统的安全性。通过将HSP抑制剂EGCG和ICD诱导剂奥沙利铂(OXA)封装,PCS在增强光热肿瘤消融(first-hit)和免疫驱动的残余肿瘤细胞清除(second-hit)方面具有巨大的潜力。值得注意的是,不同的药物释放机制可能导致EGCG和OXA在pH-/热触发下的释放量差异。进一步的体内实验证实了磁共振成像(MRI)引导的“双点击”协同治疗和药物加载PC的长期有效治疗特性。
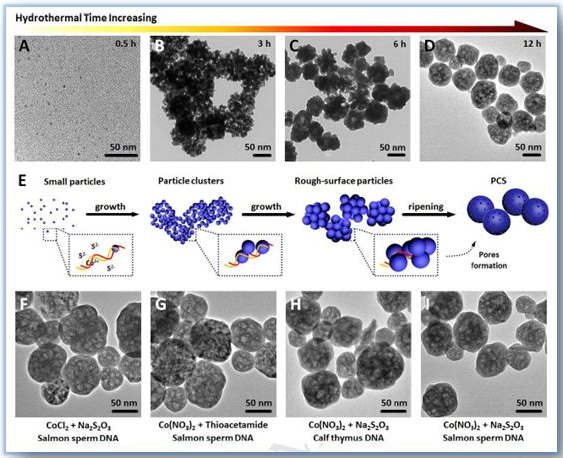
Figure 1. DNA模板水热法合成PCS的机理研究。产品在DNA模板水热过程中的透射电镜图像0.5小时A), 3小时 B), 6 小时 C), 和12 小时 D)。E)PCS成核及增长过程。F-I)不同前体和DNA模板,利用DNA模板水热法制备的PCS的透射电镜图像
总结:首都师范大学周晶课题组提出了一种新的DNA模板水热法合成高比表面积(107.19 m2 g-1)、优异的光热转换效率(44.5%)和潜在的T2增强磁共振性质(r2=183.23mm-1s-1)的多孔Co9s8纳米平台。低细胞毒性和体内毒性为其生物应用的安全性提供了有力的证据。以PCS为给药载体,具有EGCG(45.6%,EGCG/PCS,w/w)和OXA(28.2%,OXA/PCS,w/w)的高载药效率,以及pH和热触发的逐步释药等优点。由于EGCG能抑制HSP90的功能,因此暴露于PCS-EGCG-OXA的肿瘤细胞对热敏感,从而提高了光热治疗效率(first-hit)。更重要的是,加载的OXA通过激活体内免疫效应(second-hit),将死亡的肿瘤细胞转化为疫苗,清除光诱导热疗后残留的肿瘤细胞,从而尽可能降低复发的可能性。体内肿瘤消融术实验和再激发实验为肿瘤的高消融术效率和长期免疫抑制复发提供了坚实的证据。这项工作特别为多孔纳米材料的合成提供了一种新的策略,并强调了免疫疗法作为辅助典型治疗方法以实现低复发风险的有效癌症治疗的“second-hit”方法的可行性。
✔周晶教授简介

周晶,教授(图片来源于首都师范大学官网)
【个人简介】
周晶,教授。自2012年获得博士学位后独立开展研究工作,2016年破格申请成为首都师范大学化学系教授。研究方向为:1)基于多功能复合纳米材料的恶性肿瘤诊疗一体化研究;2)基于无机稀土荧光探针的活体小分子监测与疾病逻辑诊断研究;3)基于光功能聚合物纳米材料的高效抑菌与机理研究。针对新型稀土纳米探针的可控合成、理性修饰和生物应用研究方面开展工作,在生物小分子检测和肿瘤诊疗一体化领域取得了具有一定特色的原创性研究结果。
【获奖荣誉】
周晶教授2019年被评为北京市教育委员会“北京市属高校高水平教师队伍建设支持计划”青年拔尖人才;2018年获得共青团首都师范大学委员会“五四青年奖章” ;2015年被评为中共北京市委组织部“北京市高层次创新创业人才支持计划”青年拔尖人才;2015年被评为首都师范大学“青年燕京学者培育对象”。
【研究成果】
周晶教授作为课题负责人主持北京市自然科学基金-市教委联合资助科技计划重点项目一项;主持北京市教委高校青年拔尖人才计划项目一项;主持北京市委组织部青年拔尖人才项目一项;主持北京市教育委员会科技计划面上项目一项;主持国家自然科学基金青年基金项目一项。截止2019年1月,在国际化学、材料学、医学高水平期刊Chem. Rev.、Chem. Soc. Rev.、Adv. Funct. Mater.、Chem. Sci.、Biomaterials、Theranostics和Anal. Chem.发表SCI论文46篇,其中第一/共同第一作者和通讯作者论文30篇(IF大于6.0的26篇)。相关工作被Nature及其子刊、J. Am. Chem. Soc.、Angew. Chem. Int. Ed.、Phys. Rev. Lett.等国际顶尖期刊评述、引用4145次,单篇引用最高933次,5篇论文为所属领域引用Top1%的论文(ESI高引论文),获国家发明专利授权9项,申请国家发明专利21项。