| 导 读
2019年12月9日, 美国西奈山伊坎医学院华人科学家金坚教授与Ramon Parsons教授联合在Nature 子刊Chemical Biology杂志(IF: 12.15)上发表了题为“Discovery of a first-in-class EZH2 selective degrader”的研究论文。研究人员利用疏水性标记方法,得到了候选物MS1943,它是一种EZH2选择性降解剂,有效降低了细胞中EZH2的水平。更重要的是,实验证明MS1943在多个TNBC细胞中具有强的细胞毒性作用,同时不影响正常细胞,且在体内也是有效的,这是首次报道EZH2的药物降解剂用于治疗依赖于EZH2的癌症治疗。
| 内 容
肿瘤的发生与进展与表观遗传有密不可分的关系,使得靶向表观调控蛋白的抑制剂得以开发,如EZH2抑制剂,HDAC抑制剂,DoT1L抑制剂,BRD4抑制剂。其中EZH2是重要的组蛋白甲基转移酶,催化组蛋白H3K27甲基化,从而调控基因的表达,对细胞分化等起到一定的作用。H3K27me3促进多类肿瘤的发生和进展,并且EZH2与肿瘤恶性化程度和不良预后十分相关。
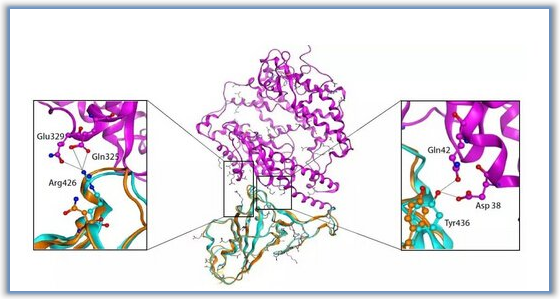
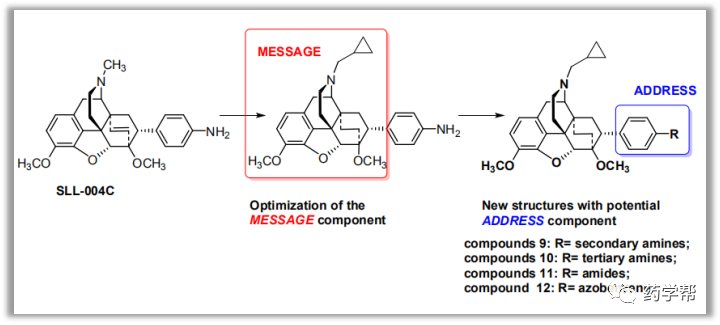
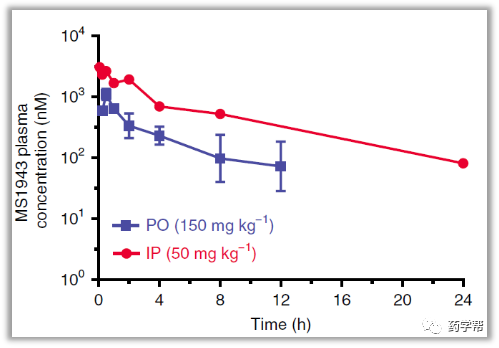
金坚教授团队一直致力于EZH2抑制剂的开发,如UNC1999和C24。目前临床上EZH2抑制剂在一部分血液肿瘤中变现不错,然而在实体瘤中表现不够理想。PROTACs蛋白降解技术近些年类得到了学术界和企业界的广泛关注,然而以疏水标签技术(hydrophobic tagging)为降解手段的报道相对较少。该研究基于C24改造的疏水标签降解剂MS1943在TNBC细胞系MDA-MB-468获得了很好的体内外结果。这也是第一次报道高选择性EZH2降解剂,MS1943对EZH2的选择性优于同源家族EZH1 200倍。有趣的是,C24可以显著的降低H3K27me3,而MS1943对H3K27me3或者H3K27me的影响无显著变化。MS1943比C24抑制MDA-MB-468细胞的生长更具有优势。这表明MS1943抑制细胞增殖不仅仅是通过降低H3K27me3的含量,还有其他的机理。MS1943可腹腔注射,有口服,具有不错的PK结果。
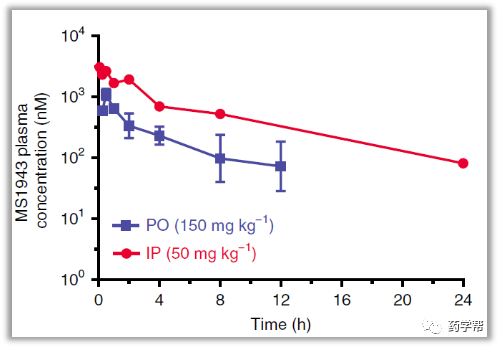
图片来源于Nature 子刊Chemical Biology杂志
体内的实验表明,MS1943可以有效抑制MDA-MB-468的肿瘤生长。从EZH2,H3K27me3,cleaved caspase-3, Ki-67的免疫组化结果得到,MS1943在体内有效降解EZH2。 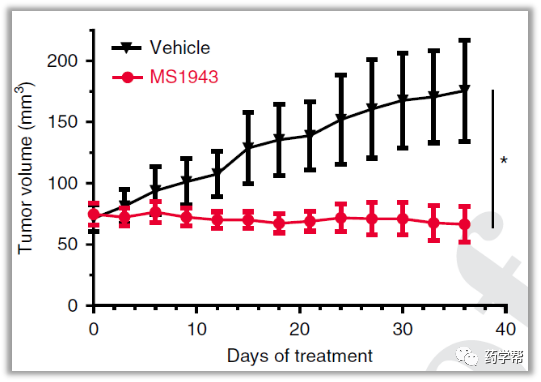
图片来源于Nature 子刊Chemical Biology杂志
为研究MS1943如何导致MDA-MB-468凋亡的机制,GSEA分析表明MS1943激活UPR相关信号通路,引起内质网应激反应。总结:该研究第一次将靶向EZH2的降解剂用于TNBC的临床前研究。这项研究表明EZH2降解剂克服的EZH2抑制剂的一些限制。相对于其他研究人员发展的EZH2降解剂,MS1943对EZH2具有很好的选择性。全文:https://www.nature.com/articles/s41589-019-0421-4✔金坚教授简介

金坚,教授,世界著名药物化学家
个人简介
1991年获中国科学技术大学化学理学学士学位,1997年获美国宾夕法尼亚州立大学有机化学博士学位。在俄亥俄州立大学(Ohio State University)完成博士后培训后,金博士于1998年加入葛兰素史克(GlaxoSmithKline),成为一名药物化学家。2008年,金博士以副教授的身份加入北卡罗来纳大学教堂山分校(University of North Carolina at Chapel Hill, UNC)化学生物学和药物化学学系。2008年至2014年,任北卡罗来纳大学(UNC)综合化学生物学和药物发现中心(Center for Integrative Chemical Biology and Drug Discovery) 药物化学副主任。2014年,金教授被聘为西奈山伊坎医学院终身教授。现任西奈山新药开发中心主任和西奈山冠名教授。金教授先后在国际专业权威期刊发表了学术论文超过150篇,超过100个特邀演讲,和超过50项美国专利和PCT专利申请。金教授的实验室在组蛋白甲基转移酶的选择性抑制剂开发和G蛋白偶联受体选择性配体发现处于领先地位,在开发针对致癌蛋白的新型小分子降解物方面也处于领先地位。2018年,金坚教授作为联合创始人创办了新锐公司Cullgen,侧重于PROTAC降解药物的开发。”