| 导 读
2019年8月7日,吉林大学化学院杨英威教授在Cell子刊Matter杂志上,发表题为“Stimuli-Responsive Drug Delivery Systems based on Supramolecular Nanovalves”的论文。超分子化学被认为是一个连接生物学、化学和材料之间的桥梁。研究人员通过对超分子治疗学的各种类型的药物传递系统的介绍,综述了典型的智能药物输送系统固定的超分子聚合物或超分子紫杉烷类作为门控实体的纳米分子机器的最新进展。
| 内 容
超分子化学被认为是一个连接生物学、化学和材料之间的桥梁。从能够对多种外部刺激作出反应的非共价相互作用的动态、可逆和定向方式中得到启发和灵感,安装在无机纳米载体或杂化纳米载体表面的超分子纳米阀在小分子药物的刺激反应传递方面受到广泛关注。超分子纳米阀的状态可以通过转换组件的构造或组装/拆卸状态来很好地调节。
由于对微观世界的深刻洞察促进了医疗保健和前沿科学的发展,超分子化学继续在科学上攀登新的高度。过去几十年标志着人工分子机器和智能超分子装置的出现,以及具有良好的机械和可逆特性,能够在大环化学和主客体化学的基础上产生预期的刺激反应,从而极大地推动了生物医学材料等材料科学的发展。良好的超分子组件是指用于包裹药物的安全和逃逸的门控装置。作为超分子化学的重要参与者,可逆的非共价相互作用包括静电相互作用、p-p堆积相互作用、疏水作用和效应、范德华相互作用和氢键相互作用,这些可以通过分子识别有效地将匹配的片段组织在一起,从而产生具有可裁剪大小、形态和功能的有序超分子纳米结构,例如胶束、纳米颗粒(NP)、囊泡,以及水凝胶。此外,对外部变化作出反应的环境可操作特性是通过这种超分子组件中的组成部分的动态结合和离解来实现的。
基于灵活的模块化策略,以合成知识为指导的超分子疗法已经被提出,特别是在超分子药物传递系统的构建中。迄今为止,药物疗法仍然是处理健康问题最典型和最主要的方法。然而,药物治疗所面临的两个主要挑战涉及到由于非特异性攻击性对正常组织的不利入侵和在患病细胞内实现持续释放的困难。基于药物安全性和有效性的需要,科学家们对门控材料进行了广泛的研究,主要包括超分子聚合物和超分子准轮烷对药物的刺激反应,这赋予了给药系统的灵活性和稳定性。
近年来,超分子纳米阀固定的药物传递系统已经在医学中应用,成为一个广泛关注的热点课题。这种功能传递载体通常由多孔无机或混合支架组成,安装在纳米载体表面的可切换门控装置可用于阻挡和解锁孔入口。因此,研究的重点是在固体表面或生物界面上嫁接超分子开关。
超分子纳米阀可以被光照、酸碱度、热、氧化还原、竞争结合、磁场、化学反应等外部刺激所触发。在工程纳米材料的基础上,超分子纳米阀将不同的模式和多边优势整合到一个复杂度极高的简单载体中。结合复杂的门控纳米技术,合理的药物传递过程可分为三个部分:(1)将药物分子加载到纳米载体的通道中,纳米载体的表面已用杆状物进行修饰,以便与门控大体积材料相互作用;(2)安装纳米阀门。为了关闭气孔,防止药物泄漏;(3)引入预先确定的刺激物,以调节/打开门实体,并将药物释放到患病细胞中。这些可行的门控材料改进了传统药物/基因传递系统的性能,以增强其功能。通过仔细选择生物相容性构建基块和内源性触发器来增强治疗效果,这使获得的组件具有多种刺激反应性,在精细调节药物分子的转运和调节运动方面具有重要的前景。
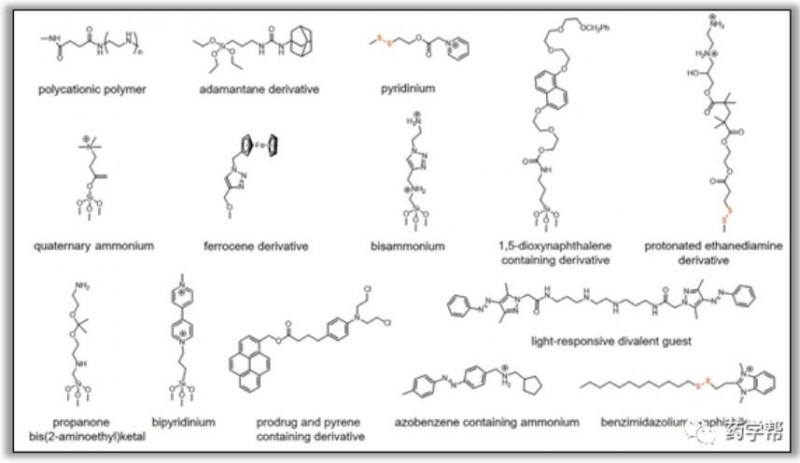
图1.超分子纳米阀结构中几种典型杆组分的化学结构
(1)介孔二氧化硅纳米颗粒(MSN)载体作为刺激反应药物释放
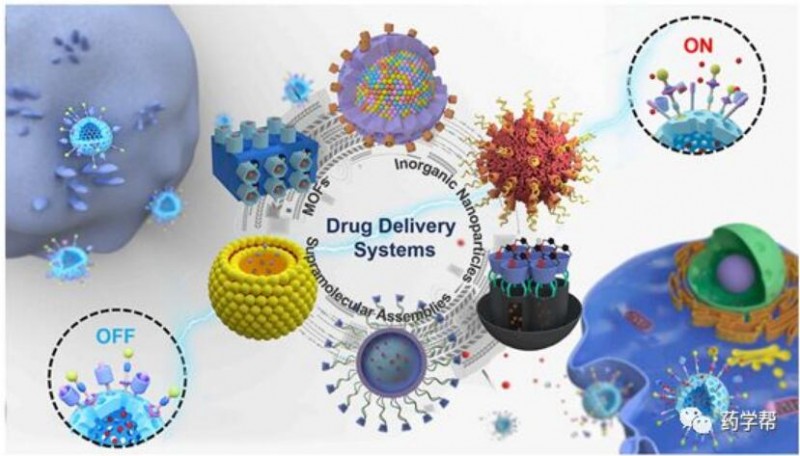
图2.与超分子纳米阀结合的可控制药物输送系统的示意图。本综述所述系统基于无机纳米粒子(NP)、金属有机框架(MOF)和超分子组件。
多孔硅材料的纳米载体是研究最深入的无机纳米载体之一。自1952年,多孔硅的出现,使其在生物医学中的得到广泛的应用,直到1992年发现介孔二氧化硅纳米颗粒后,肿瘤治疗药物输送正式开启了蓬勃发展的进程。介孔二氧化硅纳米颗粒具有几何结构可调、载药量高、刚性好、表面功能可定制、比表面积大、生物相容性好等多种优点,可以作为比其他无机支架更强大的纳米载体。由于化学惰性和明确的表面特性,介孔二氧化硅纳米颗粒被认为是易于内化的理想候选材料,对微生物攻击和变性具有良好的抵抗力。在门控纳米器件中加入介孔二氧化硅纳米颗粒不仅使治疗载体具有增强的渗透性和保留作用,而且由于其可调的粒径和可切换的孔入口,为实现多功能提供了相当大的潜力。
目前,光作为一种刺激物具有许多优越性,取决于光在空间和时间上的易操作性、远响应性和可控性,其中近红外(NIR)光由于具有深层组织渗透性和无创性而被认为是一种很好的替代品。光化学脉冲是基于光异构化、光解和光导等多种光化学机理的一种有效的按需释放药物的方法。具有光触发疏水性至亲水性开关的超分子纳米阀已被开发用于核壳纳米载体(图3a)中抗癌药物(阿霉素[DOX])的近红外光激活传递。通过对上转换纳米颗粒(UCNPs) (NaYF4:Yb, Tm@NaYF4)核表面涂上MSN壳,获得了UCNP@MSN材料,进一步将疏水性2-重氮-1,2-萘醌(DNQ)作为主茎进行锚定。然后加载DOX分子和宿主分子等,β-环糊精作为门控分子,通过β-环糊精疏水腔与疏水性DNQ秸秆的疏水相互作用,封住UCNP@MSN材料的通道。在近红外光诱导的DNQ的疏水-亲水转变的基础上,生成3-二烷羧酸(ICA)的亲水产物,导致门控组装的离解,实现DOX的按需释放。在近红外光照射下,纳米复合了UCNP核,促进了DNQ向ICA的转化。体外和体内实验结果均表明,DOX加载的UCNP@MSN对Hela细胞具有有效的抑瘤能力,为近红外光调控肿瘤治疗开辟了新的途径。
异常的肿瘤细胞内微环境,如内分体和溶酶体中的异常酶含量和高酸性酸碱度,可以直接刺激纳米阀门的开启和药物释放的孔入口的开启。2015年,杨英威研究小组报告了一个基于葫芦尿苷的动态纳米阀系统,该系统由葫芦[7]尿苷和原二胺形成的交联超分子网络而制成的超分子门控器。用二硫键将原二胺改性的聚甲基丙烯酸缩水甘油酯(PGMAs)接枝到介孔二氧化硅纳米颗粒表面,通过离子偶极相互作用形成1:2的主客体与原二胺形成1:2的主客体复合体,引入葫芦[7] 尿苷封闭DOX。形成动态超分子交联聚合物链作为可分离的载体。在较低的酸碱度和较高的谷胱甘肽(GSH)浓度下,由于宿主-客体络合物的破坏和二硫键的断裂,杂交材料表现出良好的释放性能,在癌A54细胞中发现了明显的生长抑制作用。
2018年,由Li组构建了一个以per-6-硫-β-环糊精修饰的超小型CuS-NP(Cd-CuS)作为封端的药物传递系统。在这一贡献中,苯并咪唑修饰了荧光Aiegen嵌入的介孔二氧化硅纳米颗粒作为纳米载体,随后通过宿主-客体相互作用,CD-CUS作为光热剂用于协同化学光热癌症治疗(图3b)。值得注意的是,由于纳米阀的pH响应和光热特性,在酸性环境或808nm近红外照射下,所获得的DOX加载MSN@CUS显示出有效的抗癌能力。此后,用紫外-可见分光光度法测定药物释放性能,荧光显微镜成像,并在808nm激光照射下,固定时间间隔记录光热性能评价。最后,对胃癌细胞株(SGC-7901细胞)进行了化学光热疗法,通过进入细胞核破坏DNA,揭示了胃癌细胞株在酸性环境下对肿瘤治疗的有效释放。本研究将光热效应、细胞成像荧光生物标志物和酸刺激反应药物在一个罐中释放相结合,证明了在肿瘤治疗和细胞成像中多功能传递载体的可能性。
Wang组设计了一个单茂铁修饰的β-环糊精(FC-β-CD)作为pH/Redox双反应超分子纳米阀,如图3c所示。在纳米阀中,由于酸可剪切的缩酮键和自络合与自解离之间的可逆氧化还原反应转变,其释放行为可能受到酸碱度和电压活化的影响。值得注意的是,生理pH值(7.4)下的零提前释放和按需释放可以通过程序化模式以两种释放方式进行。在形态1中,电压和酸刺激的连续暴露导致胶囊药物吉西他滨(Gemcitabine,Gem)和DOX的按顺序可控释放,而形态2中,Gem和DOX由于酮基在酸性条件下的酸水解,一起从MSN中逃逸。这项工作为开发智能传递系统以满足药物释放的不同需求提供了一种很有价值的替代方案。
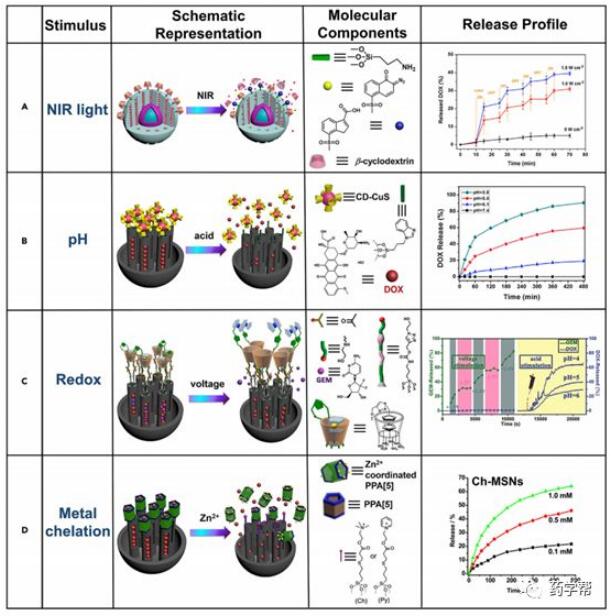
图3.介孔二氧化硅纳米颗粒表面超分子纳米阀的示意图
(a)近红外(NIR)光触发环糊精基超分子纳米阀图。
(b)用环糊精修饰的CUSNP作为阿霉素(DOX)药物控制释放。
(c)一茂铁官能化环糊精作为氧化还原触发释放DOX的门控材料。
(d)以磷酸化柱芳烃为基础的超分子纳米阀图。
为解决肿瘤异质性在抗癌治疗中的局限性,Liu组在2018年从模块化策略的角度报道了一种纳米级药物传递系统(DOX@PRMSNs),该系统使用含有吡啶二硫化物的MSNs作为DOX和聚β-环糊精(PCD)的容器门卫。随后,PCD封住了孔,防止了药物通过自组装泄漏。在吡啶基与β-环糊精空腔之间,由于吡啶的质子化和逸出,使β-环糊精空腔的酸碱度较低,可能发生紊乱。此外,还引入了含有靶向配体或聚乙烯亚胺阳离子聚合物的金刚烷基(Ad)端接体,用于环糊精与Ad部分之间的自组装,并赋予纳米复合物精确的释放和基因共传递功能。体外释药实验和转染活性的测定证实了本方案的可行性。
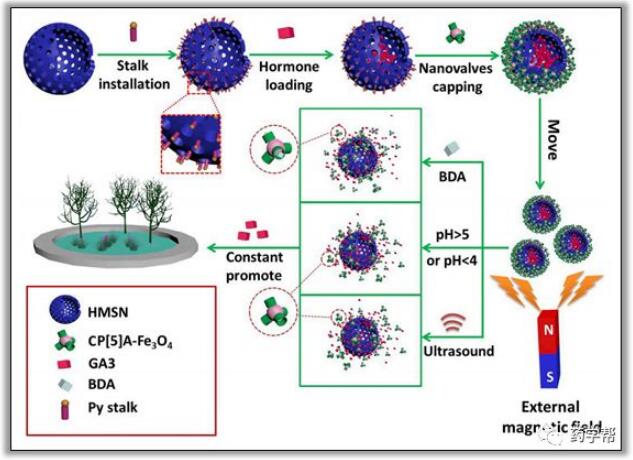
图4.磁性超分子纳米阀制备的示意图,用于多刺激响应货物释放BDA,1,4-丁二胺;HMSN,中空介孔二氧化硅纳米粒子;GA3,赤霉素。
例如,Huang等人在2017年设计并报告了一种用于化学光热肿瘤治疗的磷酸化柱[5]芳烃阀(PPA[5])输送系统。他们在金纳米棒(GNR)嵌入的MSN(GNR@MSN)表面安装了胆碱或吡啶,通过季铵盐和膦酸盐部分之间的离子对进一步与PPA[5]发生主客体络合,如图3d所示。由于与PPA[5]的配位和竞争性结合,富集的Zn2+离子或竞争性的甲基紫精可诱导纳米阀的打开。实验结果揭示了开发智能多响应交付系统的宝贵见解。最近,杨英威课题组在促进植物生长方面应用了一种新型的磁性纳米阀系统,如拟南芥和卷心菜(图4)。中空的MSN(HMSN)具有较大的负载赤霉素(GA3)作为植物激素的能力。由于药物在酸性和碱性条件下都可以释放,因此该多功能输送系统显示双向的pH响应释放。此后,研究人员还利用了1,4-丁二胺(BDA)和超声等外界刺激,以持续释放的方式触发了GA3的可控释放,该研究为农业生产提供了一种有价值的方法。
(2)金属有机骨架(MOF)纳米载体用于刺激反应药物传递
金属有机骨架(MOF) 纳米载体是一种受到广泛关注的新型多孔材料,其来源于有机连接体与金属离子或簇合物的结合。基于混合材料的发展,MOF被认为是构建多功能纳米器件的合理候选,在纳米技术和材料科学中显示出惊人的潜力。由于MOF具有可裁剪的孔径、多功能性、高载药量、结构可调、生物降解性、形态多样等优良性能,因此将MOF作为药物载体应用于刺激反应控制已引起了广泛关注。此外,从表面化学和包合化学的角度,越来越显著地证明了MOF在纳米医学应用中的改进。到目前为止,科学家们一直致力于利用MOF衍生的智能载体进行有效的治疗,满足复杂的需求,特别是药物输送和肿瘤治疗。
考虑到MOF的生物相容性和高有序多孔性的提高,杨英威课题组构建了一种多功能Fe3O4@MOF核壳纳米复合材料,该复合材料具有刺激反应、药物缓释和磁共振成像(MRI)功能。采用原位生长法在Fe3O4芯表面包覆UiO-66-Zr-MOF壳制备Fe3O4@UiO-66-NH2复合材料,并将水溶性柱[6]芳烃(WP6)安装在改性的1-(6-溴己基)溴化吡啶(PY)秆和5-Fu包封的核壳纳米复合材料上。通过形成一个庞大的准轮烷结构。值得注意的是,可移动的WP6门控Fe3O4@ UiO66@WP6材料赋予了Theranostic纳米载体对pH、温度和竞争剂的多重响应,这是由于动态软管结合。磁芯所具有的便捷的磁选和磁共振引导性能使复合材料成为肿瘤治疗的多功能载体。值得注意的是,紧密的宿主-客体结合使持续癌症治疗的释放时间延长了7天以上。
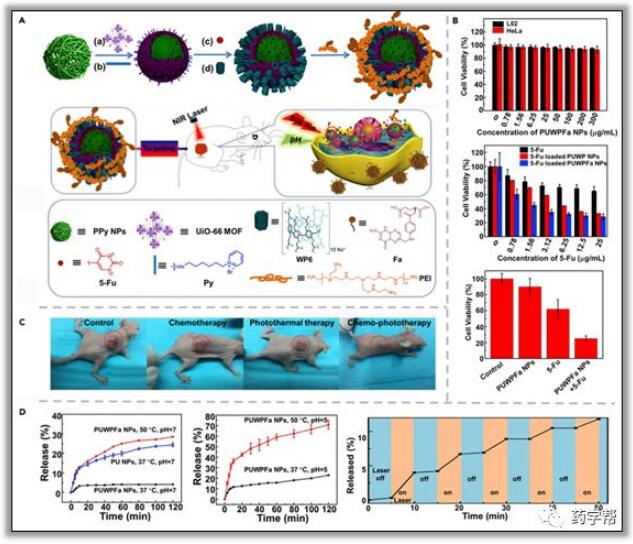
图5.以UiO-66 MOF作为药物载体和支柱构建的化学光热纳米治疗系统图
同年,杨英威课题组继续构建了另一种pH/温度双响应柱[6]芳烃阀控纳米载体,用于具有理想靶向能力的多模化学光热疗法(图5)。根据逐层组装策略和表面工程概念,使用具有不同的特定功能的T模块化组件,例如,具有理想光热转换能力的聚吡咯纳米颗粒(PPY纳米颗粒),具有高载药量的UiO-66 MOF支架用作壳,叶酸共轭聚乙烯亚胺(PEI-F)通过静电相互作用,作为最外层的主动目标实体。然后,将制备好的PPY纳米粒和UiO-66纳米杂化物配备基于柱[6]芳烃的准轮烷,然后对PEI-Fa进行改性,得到PPY@UiO-66@WP6@PEI-Fa杂化的纳米粒(PUWPFa NPs)。在808nm的照射下,PPY纳米颗粒产生的光热效应加速了用于癌症治疗的5-Fu药物的释放。
(3)其他超分子组件用于刺激反应药物传递
a. 超分子囊泡
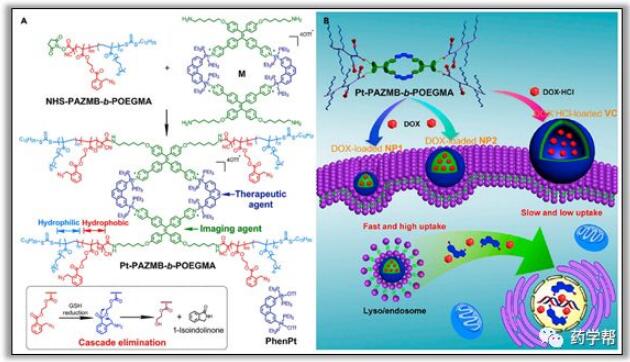
纳米药物通过响应链加速了超分子聚合物纳米材料的发展,由于纳米材料具有强大的共价结合,这为克服传统高分子药物的局限性提供了可行的选择,包括克服复杂的代谢和消除过程,以及潜在的不良反应。受可逆连接驱动的超分子囊泡在药物运输领域受到了广泛关注,特别是超分子大环和软管相互作用。用于药物输送的超分子囊泡通常是由非共价连接的两亲体共同组装而成。Yu等设计了一种两亲性共聚物,即Pt-Pazmb-Bpoegma,与聚集诱导的发射金属环结合,用于活体细胞成像和四个具有GSH响应特性的二嵌臂,可自组装成具有不同形态的纳米颗粒或囊泡,并可与Var结合。在实验条件下,如图6所示。研究发现,纳米颗粒和囊泡中都含有抗癌3,6-双[反式-Pt(PEt3)2]菲(Phenorphene),可以包裹DOX以达到协同抗肿瘤效果。聚合物的两亲性可以通过谷胱甘肽引发的级联消除和纳米结构的分解来控制货物的释放来改变。

研究人员不遗余力地致力于构建具有定向键和可逆性质的纳米结构超分子聚合物。沿着这条路线,Yu和同事们使用合适尺寸的β-环糊精和喜树碱(CPT)作为构建基块,通过二硫键桥接形成GSH反应性超分子聚合物Theranostic NPS(图7)。通过形成一个Hostguest包合物,CPT得到了很好的保护来对抗生理条件。此外,还引入了靶向配体和PEG壳的CPT-PEG-RGD(喜树碱-聚乙二醇-精氨酰-甘氨酰-天冬氨酸),用于多氢键超分子纳米颗粒的协同稳定、P-P堆积作用和主客体相互作用。研究了该系统暴露于GSH后的释放行为,显示在血流或细胞外基质内的释放可忽略不计,并且在治疗GSH时可立即释放。
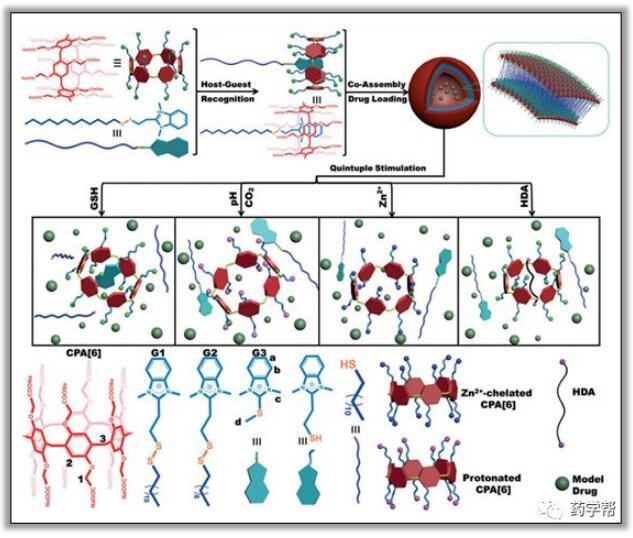
Jiang等人报道了一个典型的羧基取代柱[6]芳烃(CPA[6])的超分子囊泡,它能对五种类型的刺激作出反应,这些刺激与肿瘤微环境密切相关(图8)。两亲性微结构是由CPA[6]和二硫键合苯并咪唑客体的主客体组装而成。此后,两亲性微结构一步共同组装成约165纳米的囊泡。受异常病理过程的启发,研究者考虑了5种刺激作为激活手段,即pH、CO2、Zn2+、己二胺(HDA)和GSH。以Ru(Bipy)3Cl2和DOX为药物模型,研究药物的控释作用。因此,酸性环境和高二氧化碳水平导致CPA[6]的质子化,破坏了大环空腔与苯并咪唑的静电相互作用;同时,Zn2+与羧酸基团之间的金属螯合作用也削弱了HOST客体的相互作用。此外,HDA有望通过与大环空腔的竞争性结合来捕获CPA[6],GSH以其切割二硫键的能力而闻名,这两种能力都可能导致囊泡的解体和药物的释放。这项工作为在复杂肿瘤环境中制造具有多重反应性的智能超分子载体开辟了一个新的视角。活性氧对肿瘤细胞的DNA和蛋白质具有损伤作用,在肿瘤治疗领域发挥着越来越重要的作用。特别是线粒体对活性氧很敏感,包括过氧化物(×O2)、超氧化物(×O3)、羟基自由基(×OH)和单态氧(1O2)。
光敏剂是产生活性氧最常用的分子之一。Fan的研究小组以柱[5]芳烃和近红外吸收二酮吡咯(DPP)为基础制备了一种超分子囊泡,并将缺氧活化前药Tirapazamine(TPZ)封装到囊泡中。当系统被660纳米激光照射后,会产生1O2治疗癌症。Rui等人设计了一种光动力疗法超分子囊泡,用含季铵盐的光敏剂四苯基卟啉(TPP-QASs)为客体,与水溶性柱[5]芳烃结合,形成宿主-客体聚集体,在酸性肿瘤微环境中释放TPP-QASs,从而在光照条件下有效生成1 O2,用于光动力疗法。
b. 聚合物纳米颗粒
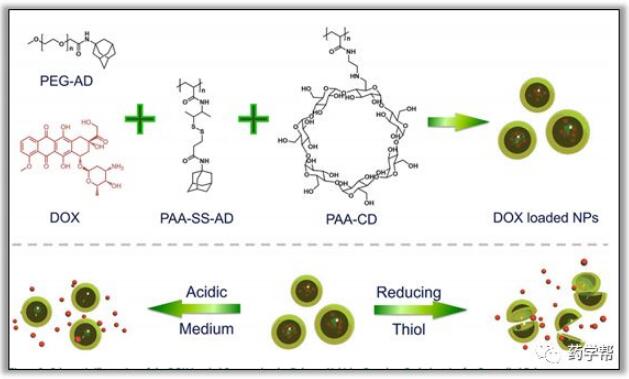
根据预期的结果,基于超分子聚合物的反应性纳米颗粒有望通过将不同的模块结合在一起,特别是对于植入生物分子的聚合物,实现有效的基因转染和药物传递。超分子组装技术与高分子载体的结合,由于其具有很低的细胞毒性和克服多种细胞外和细胞内屏障的潜力,越来越受到重视。超分子宿主-客体相互作用为功能成分和具有识别实体的生物大分子的整合提供了可行的方法,来提高生物相容性、降解性和增强细胞内化。在这里,作者重点介绍用于癌症治疗和获得性遗传疾病的基因和药物传递中的超分子聚合载体。采用动态组合化学的方法,成功地制备了一种简单的超分子策略,该策略来源于含金刚烷(Ad)的二硫键桥接聚丙烯酸(PAA-SS-AD)、β-环糊精嵌段聚丙烯酸(PAA-CD)和AD-共轭PEG5000(PEGAD)(图9)。通过静电作用加载DOX的制备系统可以对内质环境中的酸性条件作出响应,可剪切的动态二硫键对还原环境是敏感的。值得注意的是,与游离DOX相比,加载DOX的纳米粒显示出较低的全身毒性,这是由于DOX的一般非特异性毒性所致,这可以在斑马鱼幼虫肿瘤细胞的典型生存能力评估中观察到。
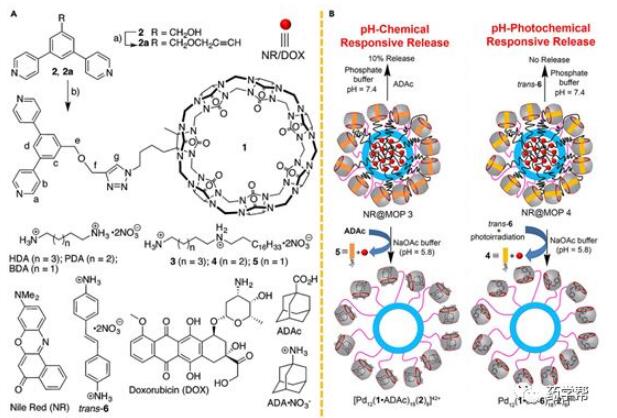
大环的共价连接为治疗剂提供了可靠和强大的保护,并在最近提出的金属-有机多面体(MOP)中得到了实现。采用金属-有机笼结构,从配体和金属离子的自组装构建MOP。通过与超分子大环的混合,在葫芦[7]尿苷衍生配体1,双(吡啶)配体2,Pd(NO3)2和特异性客体分子(如1,6-己二胺(HDA))共存的条件下,成功地构建了具有多响应释放曲线的立方八面体MOP载体。MOP载体相应的疏水内腔是由葫芦[7] 尿苷和HDA的主客体络合产生的,用于捕获疏水性DOX或尼罗红(NR)。葫芦[7]尿苷的动态宿主-客体属性使给定的载体具有刺激响应;因此,引入金刚烷铵与葫芦[7]尿苷竞争性结合,将导致疏水性纳米环境的破坏,从而允许释放药物。有趣的是,对pH化学或pH光化学引发的释放进行了进一步研究(图10),结果显示在pH 5.8下相应的中性金刚烷羧酸可以取代葫芦[7]大环内的受试物。另一方面,利用大环空腔内4,40-二氨基联苯从反式到顺式的光异构化反应,实现了远程光化学控制,导致了先前的软管络合物的离解和药物的释放。所提出的MOP显示了一个由体外评估确定的积极的治疗概况,具有显著的细胞吸收特性。
c.无机纳米载体用于刺激反应药物传递
目前有各种各样的新兴无机纳米载体在药物运输方面正在迅速发展。其他无机纳米载体的出现,如还原石墨烯氧化物(RGO)、磁性纳米颗粒、CuS纳米颗粒、掺杂稀土的UCNP纳米颗粒和空心氧化锆纳米球,将输送系统内的高承载能力和光化学或电化学性质结合在一起。在这些系统中,超分子组件还可以用来关闭与药物单体锚定的载体,并有效地管理药物卸载过程。
在智能和强大的自行纳米技术的推动下,Khezri组描述了一种有趣的微机械,n-rGO/Pt,它是由催化铂层和还原的纳米氧化石墨烯(n-rgo)层衍生而来,它可以将电化学能转化为机械运动,从而有效释放DOX。在所有的载体中,碳同素异形体因其超分子p-p层驱动的显著多轴承载能力而更具有竞争力,根据SADAF和Walder的研究,超分子p-p层驱动的多轴承载能力高达200%。据报道采用模板辅助技术,分别以纳米石墨烯为外层电沉积和以铂为内层电位沉积的方法可以制备n-rGO/Pt。因此,DOX分子的芳香结构与n-rGO/Pt共轭体系之间的P-P相互作用可以很容易地通过物理吸附加载,而不需要复杂的表面功能化。通过循环伏安扫描,当电子注入DOX@n-rGO/Pt组分时,DOX分子中的喹唑啉部分通过2e-/2H+从氧化态(蒽醌)可逆转变为还原态(亮氨酸喹唑啉)。DOX的成功排出归因于负电荷的RGO向药物分子的电子转移,最终由还原态的RGO与DOX之间的静电排斥作用引起,并进一步由电解质溶液的紫外可见光谱证实。采用DOX@n-rGO/Pt处理对T47D细胞进行细胞毒性实验,伴随荧光变化细胞发生收缩,证实了该方法的可行性。
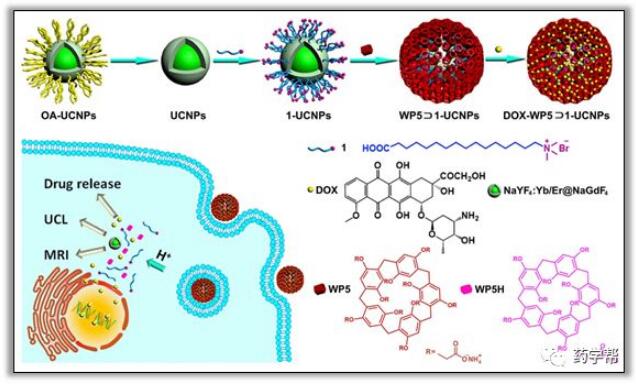
UCNP具有发射带窄、生物相容性好、可忽略的光损伤和低自荧光等独特的光学和生物特性,被认为是纳米医学中的新星,同时这些特性使其成为制备多模半导体材料的理想候选材料。不可知论和治疗性纳米载体,包括药物输送、MRI和上转换生物成像。最近,在核壳NaYF4:Yb/Er@NaGdF4 UCNPs的表面安装了一种基于亲水性羧酸盐基柱[5]芳烃(WP5)的pH响应超分子纳米阀,通过在NaYF4:Yb/Er NPs的最外表面涂上一层薄薄的NaGdF4壳来构建。UCNP的表面是以15-羧基-N,N,N-三烷基五癸-1-溴化铵为主茎进行改性,可进一步被WP5包围。在wp5和溴化铵部分疏水空腔之间的特定宿主-客体识别的驱动下,wp5环被锚定在UCNPs上,并产生用于进一步加载DOX的合成纳米杂化物,如图11所示。此外,由于添加了一系列具有不同酸碱度的PBS,使质子化的WP5发生主客体络合离解,并根据需要释放出DOX。由上转换发光光谱(UCL)可以看出,纳米杂化物的发射重叠和DOX的吸收确保了UCNP和DOX之间的非辐射能量转移。值得注意的是,在T1加权和彩色成像的磁共振图像中,加入含钆(Gd)的NaGdF4壳赋予了整个纳米混合组分强的磁共振信号,因此纳米混合组分的表现可能是生物T1的磁共振造影剂。此外,将Hela细胞与制备的材料一起孵育,这两种材料在含有DOX的纳米杂交中均表现出显著的细胞凋亡作用(72%)。并且在没有DOX的空白载体处理的细胞存活率较高(96%),表明所制备的纳米杂化物可作为药物传递的多功能平台。
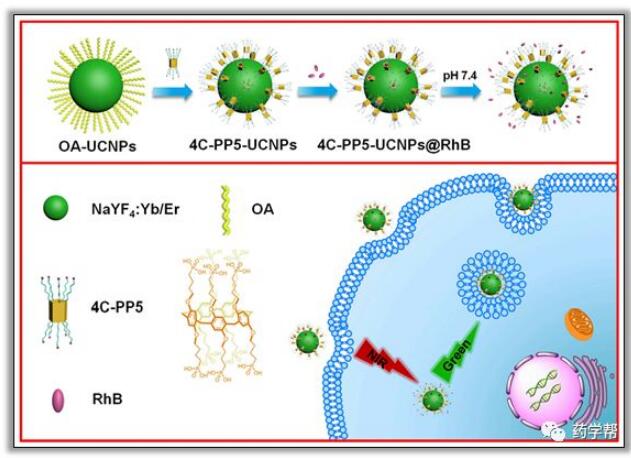
杨英威组报告了另一个基于UCNP的多功能系统,通过引入磷酸基柱[5]芳烃通过配体交换过程(图12)来修饰油酸稳定的β-NaYF4:Yb/ErUCNPs(OA-UCNPs)。在这项工作中,罗丹明B(RhB)被选为通过静电和宿主-客体相互作用加载药物模型。由于RhB的COO-基团与去质子化磷酸基团之间的静电排斥作用,纳米材料表现出相当高的pH响应释放效率。随后,对该纳米系统的生物相容性和UCL细胞成像能力进行了评价。这项工作为UCNP在生物医学应用中的应用打开了一扇新的大门。
d. 抗菌用超分子开关
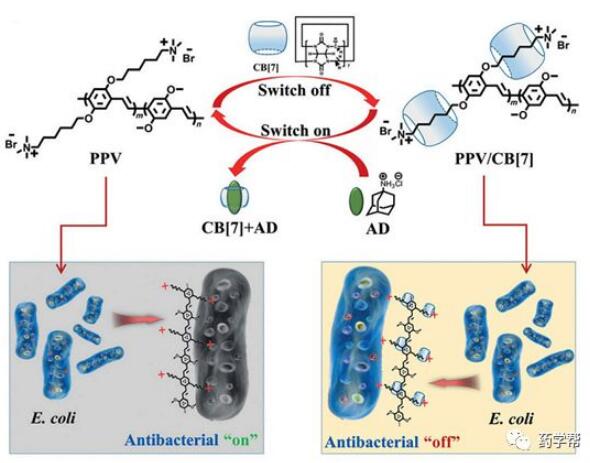
由于细菌耐药性的出现和抗生素的积累,细菌感染仍旧引起人们的广泛关注,这被认为是对公众健康的严重威胁。特别是超分子抗生素开关,它取决于自身的结构多样性,操作简便性。抗菌活性可通过超分子组装/拆卸方法进行调节,无需复杂的修饰。利用葫芦[7] 尿在阳离子聚亚苯基乙烯衍生物(PPV)中保护抗菌物质的季铵,从而验证了这一策略,通过封装季铵基团可以“关闭”与细菌的相互作用。在葫芦环(图13)的空腔内,研究人员将注意力转移到了抗菌活性上,他们利用AD与葫芦环(图7)进行竞争性结合,从而使抗菌物质能够接触到细菌。引起高的大肠杆菌的杀灭率(70%),该抗菌实验结果证实了该策略的可行性。
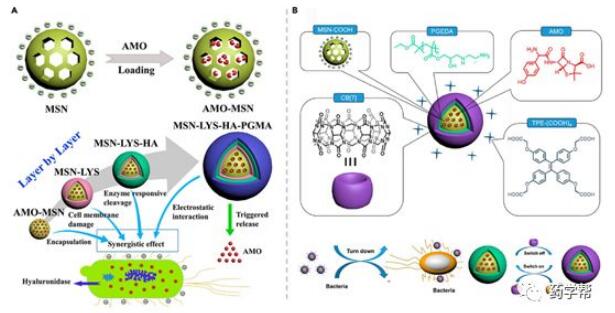
杨英威课题组与Wu课题组采用分层自组装策略,在MSN外涂溶菌酶(Lys)、透明质酸(HA)和1,2-乙二胺(EDA)修饰的PGMA(以阿莫西林为抗生素,构建了另一个抗菌载体(Figu)。在这个系统中,Lys和阳离子PGMA作为多价相互作用的提供者与细菌膜接触。所制备的混合材料MSN-Lys-HA-PGMA对革兰氏阳性金黄色葡萄球菌具有良好的抗菌作用,并具有透明质酸酶反应的抗菌作用。随后,杨英威课题组在2017年提出了一种新的超分子纳米组装,通过EDA-改性PGMA、葫芦[7]尿苷l和Aiegen四苯基乙烯羧酸衍生物TPE的逐层自组装,可以同时检测细菌并导致细菌消除(图14b)。在MSNs.表面,细菌与纳米组装之间的相互作用减弱了阳离子PGMA与TPE-(COOH)4层之间的连接,导致TPE实体的荧光发射减少。此外,添加AD与葫芦[7]尿苷形成竞争性结合,并导致加载的AMO释放。因此,这种纳米组装对致病性金黄色葡萄球菌和大肠杆菌具有响应性抗菌活性。本研究开发了一种双功能辅助抗菌纳米载体,用于细菌的清除和检测。
总结:通过对超分子大环实体所封闭的各种类型的药物传递系统的研究,杨英威课题组对超分子治疗学的最新进展进行了详细的综述。纳米医学的主要目标是有效地减少过早释放对正常器官的严重副作用,这可以通过使用超分子门控技术来实现,这归因于其所具有的优点,包括刺激反应,动态和可逆连接,灵活性和可控性。
如前所述,超分子纳米阀可分为两类:(1)构象阀是研究人员最早研究的超分子门控材料,门控在多孔和固体载体(如MSN和MOFS)表面。(2)概念阀具有切换功能;但是,它们也参与载体的制造,而不是安装在输送系统的外部。最近的进展集中在满足医疗领域的多边需求,具有良好机械性能的超分子纳米阀已被证明是以响应方式调节小分子药物进入的强有力的助手。肿瘤组织的异常生理状态可作为良好的内源性刺激,避免外界刺激引起的不良损伤。这些具有代表性的实例表明,超分子疗法比其他现有方法具有竞争优势,特别是在实现特定位点释放和处理生物屏障方面。
尽管在超分子治疗领域取得了令人兴奋的成就,但迄今为止报道的能够在一个系统中集成诊断、治疗和追踪的多功能纳米载体很少。从这个意义上说,需要多学科的合作,将应用扩展到临床试验中,特别是那些密切相关学科的科学家、工程师和临床医师,如材料科学、化学、生物学、药理学、纳米技术和工程。此外,由于在活体和临床模型中可能出现不可预见的困难,应加强对这些超分子治疗系统在各级的稳定性、生物分布、生物降解性、代谢途径和生物安全性的研究。
✔杨英威教授简介

杨英威教授
吉林大学化学学院、纳微构筑化学国际合作联合实验室教授、博士生导师。科睿唯安2017年“全球高被引科学家”;爱思唯尔2017年和2018年“中国高被引学者”。主要从事有机超分子化学与材料研究。迄今已在Acc. Chem. Res., Matter, Chem, Adv. Mater., JACS, Angew. Chem. Int. Ed., Chem. Soc. Rev., Research, Chem. Sci., Nano Lett., ACS Nano, Chem. Mater., Small, ACS Appl. Mater. Interfaces, Theranostics, Org.Lett., Chem. Commun., Macromolecules, Polym. Chem., Chem. Eur. J.,Nanomedicine, J. Mater. Chem., Chem. Rec., Sci. Rep.等期刊发表SCI论文160多篇。研究工作被Nature, Nature Chemistry, Nature Materials, Science Daily, ACS Note worthy Chemistry, Chemistry World, Chemistry Views, Elsevier, Materials Views China等杂志媒体专门报道或亮点评述。担任欧盟委员会、以色列科学基金会、比利时弗兰德研究基金会、智利国家科学技术委员会、英国肺基金会、国家自然科学基金、博士后科学基金等国内外基金会评专家或特邀评审人;主持国家自然科学基金面上项目多项、教育部博士点基金和省校其他各类基金共十余项。科研成果获吉林省自然科学奖一等奖,吉林省自然科学学术成果奖二等奖,入选2013年中国百篇最具影响国际学术论文,领跑者5000中国精品科技期刊顶尖学术论文,获评多个杂志优秀论文和高引论文;入选英国皇家化学会Polymer Chemistry PioneeringInvestigator和ChemComm Emerging Investigator、吉林省第六批拔尖创新人才、吉林大学培英工程计划、吉林大学国家杰出青年基金后备人选培育计划、吉林大学化学学院青年教师创新能力提升计划等。