| 导 读
2019年5月8日,北京大学化学与分子工程学院陈鹏和王初课题组在Nature主刊发表题为“Time-resolved protein activation by proximal decaging in living systems”的文章,两个课题组合作发现了一种生物系统中近端衰变的时间分辨蛋白激活方法,即“计算辅助和基因编码的近端衰减”策略。这一方法的发现对动态生物学过程的研究具有里程碑的意义。传统的研究方法都是以细胞功能丧失的方式进行的,而“计算辅助和基因编码的近端衰减”,可以在保持细胞正常功能条件下进行动态生物学过程的研究,陈鹏和王初课题组解决了长期困扰动态生物学研究过程中的一大挑战。
| 内 容
近日,北京大学化学与分子工程学院陈鹏课题组和王初课题组合作报道了“计算辅助和基因编码的近端衰减”(以下简称cage-prox)策略,用于功能保留条件下的动态生物学过程的研究。该策略能够在活细胞和小鼠中激活广泛的蛋白质。通过计算设计和实现蛋白质活性的暂时性阻断,在蛋白质的功能位点附近加入一个光笼氨基酸,在蛋白质衰变后可以迅速去除,从而导致蛋白质重新活化。研究证明了该方法在不同的蛋白质家族中具有广泛的适用性,这使得细胞信号和免疫反应的正交调节、caspase激活后蛋白水解酶底物的时间分析以及基于蛋白质的药物前疗法的发展成为可能。这将为笼型代理获得高精度和时间分辨率的蛋白质功能研究和动态生物过程提供了机会。
高选择性和高时间分辨率的蛋白质活性的精确干扰对于解剖从信号转导到程序性细胞死亡的各种动态生物学过程至关重要。使用传统的遗传或药理学方法,通常很难满足高选择性或时间分辨率的要求。一系列药理学和蛋白质工程方法,包括‘bump-and-hole’、PROTAC、LARIAT、‘trim-away’策略和Engineering extrinsic disorder策略,已成功应用于各种蛋白质(POI)来研究动态细胞过程,但它们通常是以功能丧失的方式进行的。因此,功能维持的方式是一种特别有吸引力的“积极”方法来探测和控制动态蛋白质活性。已经进行了大量的蛋白质工程工作来直接操纵POI,例如可转换蛋白的基因融合、光可控肽、分裂蛋白、光控制组装域或同二聚/异二聚蛋白质。这些光遗传学和化学遗传学方法允许对动态生物学过程进行选择性研究,并避免潜在的副作用和表型补偿。然而,在没有遗传融合的情况下,发展一种统一的、通用的方法来在生活条件下选择性和暂时性地激活蛋白质是非常可取的。通过基因结合的“笼状”氨基酸对催化残基进行特定部位的阻断,这种氨基酸可以通过化学或光学手段精确地降解,这是选择性和快速蛋白质活化的替代方法。目前,只有有限数量的笼状氨基酸可以被遗传编码,不同的类似物需要根据一个POI上催化残基的化学特性以逐案方式并入。此外,许多酶没有明确的催化位置,这使得它们与直接衰变不相容。在不直接依赖催化残基的生物系统中,缺乏一种普遍的基于脱钙的蛋白质活化策略。
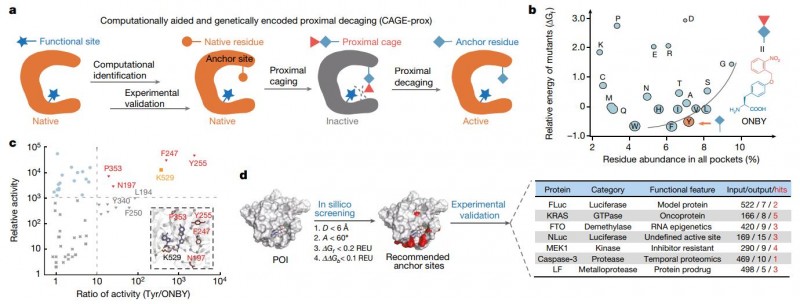
设计和开发的CAGE-prox策略(图片来源于Nature期刊)
陈鹏课题组和王初课题组用一种普通的“近端衰变”策略解决了这些挑战,在这个策略中,一种蛋白质的活性被一种广泛的笼状氨基酸暂时阻断,这种氨基酸在接近其功能位点时被引入,然后在光照衰变后立即被重新激活(图1a)。我们将此策略命名为“计算辅助和基因编码的近端衰减”。与专注于特定催化残基的直接衰变不同,笼状prox依赖于功能位点附近的统一笼状氨基酸作为暂时的“隆起”,因此,无论催化残基的是否存在和/或化学特性如何,都可用于阻断各种蛋白质的活性。
陈鹏课题组和王初课题组首先建立了一个光笼状酪氨酸ONBY21作为通用近端笼,并开发了一个计算算法,通过笼状和衰变操作来确定关闭和蛋白质活性的最佳锚定位置。接下来,验证了CAGE-prox包括GTPase、激酶、RNA去甲基酶、半胱天冬酶和细菌效应蛋白在内的多种POI功能操作中的适用性。并通过构建正交激酶信号级联、蛋白水解酶底物的时间分布和细菌效应物作为蛋白质的按需释放,进一步证明了CAGE-prox对不同生物过程的选择性、时间性探测和/或干扰的能力。

陈鹏教授(图片来自北京大学官网)
个人履历:
2002 理学学士 北京大学 化学与分子工程学院
2003 理学硕士 美国芝加哥大学 化学系
2007 理学博士 美国芝加哥大学 化学系
2007-2009 博士后,美国Scripps 研究所; 诺华制药美国圣迭戈研发中心
2009- 研究员,博士生导师,北京大学化学与分子工程学院
2011- PI,北京大学合成与功能生物分子中心
2011- PI,北大-清华生命科学联合中心
研究领域:
研究兴趣主要集中在化学与生物学的前沿交叉领域,试图通过化学家的知识与手段,为生命科学的探索提供一系列崭新的工具和研究方式。具体研究方向如下:
(1)蛋白质工程,蛋白质特异标记,蛋白质药物化学;
(2)临床感染性病菌与人体免疫系统相互作用的机理研究;
(3) 面向生物活体内的化学反应与技术;
(4)∙ 基于蛋白质的金属离子及有机小分子生物传感器的开发与应用;
重要奖励:
2014 RSC Chem Soc Rev Emerging Investigator Lectureship
2014 CAPA Biomatik Distinguished Faculty Award
2013 第十三届中国青年科技奖
2013 中组部青年拔尖人才
2012 中国化学会青年化学奖
2012 国家杰出青年科学基金
2012 SCOPUS Young Scholar, Elsevier.
2011 药明康德生命化学研究奖
2011 北京大学“挑战杯”科技竞赛优秀指导教师
2007 Elizabeth R. Norton Prize, The University of Chicago.
2005 Society of Cosmetic Chemists Award.
2004 Burroughs Wellcome Fellowship, Burroughs Wellcome Fund.
王初教授(图片来自北京大学官网)
个人履历:
2001 ,理学学士,中国科学技术大学生物学系
2007 ,理学博士,美国西雅图华盛顿大学生物化学系
2007-2009, 博士后, 美国西雅图华盛顿大学生物化学系,霍华德休斯医学研究所
2009- 2013,博士后,美国Scripps研究所化学生理系
2013- 至今,研究员,北京大学合成与功能生物分子中心,北大清华生命科学联合中心
2013- 至今,特聘研究员,博士生导师,北京大学化学与分子工程学院化学生物系
研究方向: 主要通过化学蛋白质组学,生物化学和计算生物学等多种跨领域的技术和手段,大规模发掘蛋白质组中被内源生物小分子或外源化学药物分子特异修饰的功能位点和靶点,并深入研究这些修饰对蛋白质的结构、功能以及其所在的细胞内新陈代谢和信号传导通路的影响。这些研究将有力地推动在后基因组时代人们对大量未知蛋白功能注释的进程,揭示其在各种新陈代谢通路中的关键作用,以及从分子水平上解释多种病理环境的形成和诱因,为相关的药物和治疗手段的研发提供理论基础。目前初步的工作设想包括以下几个方面的内容:
(1) 运用化学生物学和化学蛋白质组学的技术大规模挖掘在细胞处于氧化应激(oxidative stress)条件下,被内源亲电性小分子代谢产物所特异共价修饰的氨基酸功能位点。
(2) 运用生物化学、细胞生物学以及药物化学等诸多实验方法对在细胞氧化应激条件下这些被修饰的位点做深入的功能性研究,以揭示这些修饰对蛋白质结构功能和所在的代谢通路的影响。
(3) 研发计算结构生物学分子对接(protein-ligand docking)的方法,对小分子配体对蛋白质共价修饰进行结构模拟预测和分子设计,以用于小分子酶抑制剂的开发、药物设计以及对未知蛋白的功能注释。