6月25日,《美国国家科学院院刊》(PNAS)杂志在线发表了中国科学院生物物理研究所胡俊杰的研究论文“Atlastin介导的膜栓系对于货物的移动和内质网的出口至关重要”。本研究发现内质网膜融合蛋白atlastin(atl)参与调节内质网中蛋白质的流动性和膜转运,为阐明管状内质网的功能提供了新的依据。
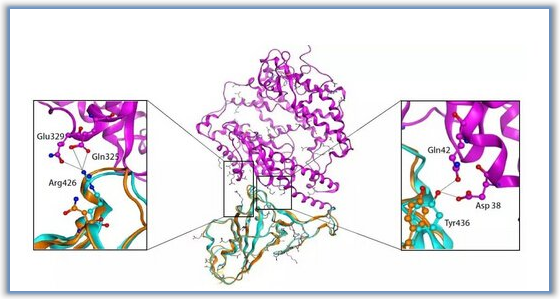
真核细胞内质网是由连续的片状结构和管状结构组成的复杂网络。纵横交错的管状网络主要由两组富含管状内质网的膜蛋白维持:Reticulons 和REEPs可诱导并稳定膜的弯曲,形成管状结构;dynamin超家族蛋白atl可诱导并稳定曲度。使膜重新形成管状结构。介导膜融合促进内质网-管状网络的构建。细胞中ATL的丢失或突变导致内质网长而不分枝的管状结构,ATL1的突变导致人类遗传性痉挛性截瘫(hsp)。胡俊杰近年来的研究成果揭示了ATL及其同源蛋白sey1p和rhd3介导的内质网同源膜融合的分子机制,以及内质网管状网络在细胞生命中的特殊生理功能和机制。活动仍不清楚。
折叠修饰后,内质网合成的分泌蛋白和其他内质系统的膜蛋白需要通过覆盖有copii(coat protein II)的囊泡转运到高尔基体。研究发现,在ATL敲除细胞中,外周copii的形成明显减少,内质网的载货蛋白输出延迟。ER出口位点的形成和分布不受ATLS缺失的影响,但许多不能进一步吸收copii-coat蛋白。半透性细胞的copii发芽实验表明,当内质网或内质网中不存在ATL时,当ATL瞬间破碎时,copii载货蛋白的包装效率会显著降低,不同载货量会影响到不同的DEG。进一步的研究发现,ATL缺乏降低了内质网中货物蛋白的流动性。有趣的是,ATl1R77A突变体不能介导融合,但能部分实现膜结合,不能完全恢复内质网的形态,但足以恢复蛋白质的流动性和copi的形成。在ATL外面。这些结果表明内质网膜附着在调节内质网中物质流动和有效包装copii货物蛋白中起着重要作用。研究表明,膜的侧向张力对膜的流动性有很大的影响,膜系可以保持膜的侧向张力。