| 导 读
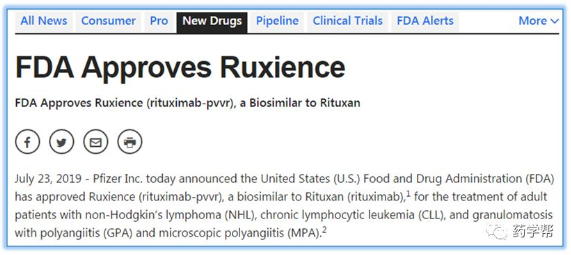
2019年7月23日,辉瑞公司宣布美国食品和药物管理局(FDA)批准了Ruxience(利妥昔单抗-pvvr),一种类似利妥昔单抗的生物制剂,用于治疗成人非霍奇金淋巴瘤(NHL)、慢性淋巴细胞白血病(CLL)和多发性肉芽肿性多血管炎(GPA)和显微镜下多血管炎(MPA)。
| 内 容
2019年7月23日,辉瑞公司宣布美国食品和药物管理局(FDA)批准了Ruxience(利妥昔单抗-pvvr),一种类似利妥昔单抗的生物制剂,用于治疗成人非霍奇金淋巴瘤(NHL)、慢性淋巴细胞白血病(CLL)和多发性肉芽肿性多血管炎(GPA)和显微镜下多血管炎(MPA)。
图片来源于互联网
Ruxience是一种单抗生物,类似于Rituxan,它的治疗靶点是一种名为CD20的蛋白,这种蛋白存在于B细胞表面。当它与CD20结合时,有助于利妥昔单抗破坏B细胞。
适应症:
(1)非霍奇金淋巴瘤(NHL)
Ruxience(利妥昔单抗-pvvr)用于成人患者的治疗:复发或难治性、低级或滤泡、CD20阳性B细胞NHL作为一个代理以前未经治疗的卵泡,CD20阳性,B细胞NHL结合一线化疗,患者达到完全或部分响应利妥昔单抗产品结合化疗,作为单药维持治疗Non-progressing(包括稳定的疾病),低级,CD20阳性,B细胞NHL,作为一个单一的代理后,一线环磷酰胺、长春新碱,和泼尼松(CVP)化疗以前未经治疗的弥漫性大B细胞,CD20阳性NHL联合环磷酰胺,阿霉素,长春新碱,泼尼松(CHOP)或其他基于蒽环类药物的化疗方案。
(2)慢性淋巴细胞白血病(CLL)
联合氟达拉滨和环磷酰胺(FC),用于治疗以前未经治疗和以前治疗CD20阳性CLL的成年患者。
(3)成人肉芽肿合并多发性血管炎(GPA)(韦格纳肉芽肿)和显微镜下多发性血管炎(MPA)
联合糖皮质激素使用。
Ruxience是罗氏品牌药美罗华(Rituxan,通用名:rituximab,利妥昔单抗)的生物仿制药。

图片来源于互联网
Ruxience是FDA获批的第2个利妥昔单抗生物仿制药。2018年11月,Celltrion和梯瓦合作开发的Truxima(rituximab-abbs,利妥昔单抗)获得FDA批准,成为美国市场批准的首个利妥昔单抗生物仿制药。
图片来源于互联网
此次批准基于对一个综合数据包的审核,该数据包证明了Ruxience与参考产品的相似性。发现与对照品相比,在安全性和疗效方面没有临床意义的差异。
辉瑞肿瘤学全球总裁安迪•施梅尔茨(Andy Schmeltz)表示:FDA的批准标志着我们今年在美国批准的第三个类似肿瘤生物,这加强了我们将这些重要药物带给癌症患者的承诺。