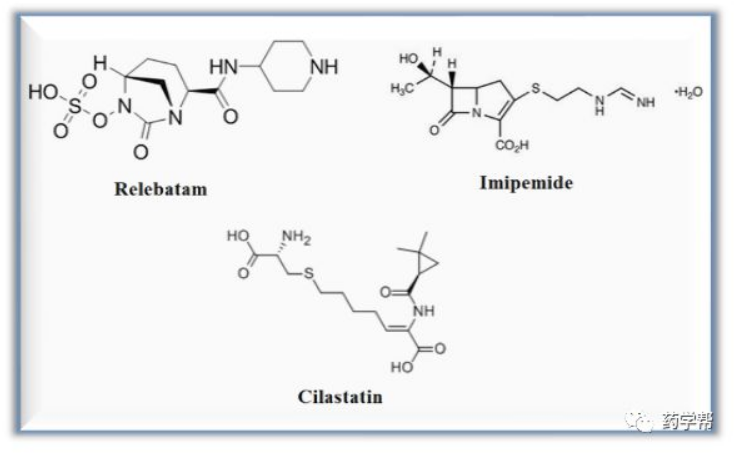
法国制药巨头赛诺菲及其合作伙伴再生元最近宣布,欧盟委员会(EC)有条件批准了PD-1肿瘤免疫疗法Libtayo(Cemplimab),用于不适合根治性手术或根治性放疗的转移性或局部晚期皮肤鳞状细胞癌(CSCC)成人患者的治疗。
CSCC是一种常见的皮肤癌。Libtayo是一种抗免疫检测点受体PD-1(程序性细胞死亡蛋白-1)的全人单克隆抗体。值得一提的是,libtayo是欧盟批准用于治疗晚期CSCC患者的第一种也是唯一一种药物。在美国,Libtayo于2018年9月获得批准,成为市场首个批准用于治疗晚期CSCC的药物。
Libtayo的批准基于开放标签、多中心、非随机二期研究Empower-CSCC-1(研究1540)和一期研究(研究1423)中两个扩展CSCC队列的汇总分析数据。这些试验为评估晚期CSCC患者的系统治疗提供了最大的前瞻性临床数据集。共纳入75例转移性CSCC患者和33例局部晚期CSCC患者。数据显示,libtayo治疗证实的客观缓解率为47%(95%CI:38-57),其中完全缓解率为4%。转移性CSCC患者全部缓解。在上一次评估中,一些患者持续缓解超过15个月,61%的患者持续缓解至少6个月。就安全性而言,最常见的不良反应包括疲劳、皮疹和腹泻。
作为有条件批准的一部分,赛诺菲和再生元需要提供来自Empower-CSCC-1研究的额外数据,包括新增加的试点小组的结果,以进一步确认Libtayo的利益风险状况。
Libtayo属于PD-(L)1肿瘤免疫疗法,是目前备受关注的一种肿瘤免疫疗法。其目的是通过阻断PD-1/PD-L1信号通路,利用人体免疫系统抵抗癌症并杀死癌细胞。它有潜力治疗各种类型的癌症。
Libtayo采用再生元专利化的Velocimmune技术平台创造并优化,目前正在再生元与赛诺菲的全球合作协议框架下进行联合开发,用于多种类型癌症的治疗。